反応速度を勉強していると1次反応や2次反応などと言った言葉を聞いたことがあると思います。
1次反応とは放射性物質(プルトニウムなど)の壊変や、あるいは過酸化物(過酸化水素など)の分解などの『1分子のみ』で起こる反応です。
2次反応とは『2分子の衝突』で起こる反応で、例えばラジカル重合などがそうです。
では《0次反応》って何なのでしょうか?
0次反応とは?
・反応速度が反応物の濃度によらず一定である反応のこと。
・速度式はv=k。
0次反応とは、化学反応の速度が『反応物(原料)の濃度に依存せず一定』な反応のことです。
つまり、反応速度に原料の大小が関係ない、というような状況の反応のことを言います。
言いかえれば、反応速度において、反応物濃度が律速ではない反応のことです。
定義
「零次反応とは、反応速度が反応物の濃度に依存しない反応である。反応物の濃度が増加することで反応が加速することはなく、反応した物質は単純に経過時間に比例する。・・・」 wikipedia(2019年9月5日現在)
wikipediaからではありますが、0次反応とは「反応速度が反応物の濃度に依存しない反応」ということが言われています。
反応速度が反応物の濃度に全く関係なく、常に一定の速度であるような反応です。
繰り返しになりますが、0次反応とはそういう反応のことを言います。
1次反応と2次反応の場合
でも普通、反応速度って反応物の濃度に依存しますよね。
反応速度が反応物の濃度に依存しないとは、どういう状況なのでしょうか。
一応おさらいで反応速度が濃度に依存する『普通』の反応を見ていきたいと思います。
例:1次反応
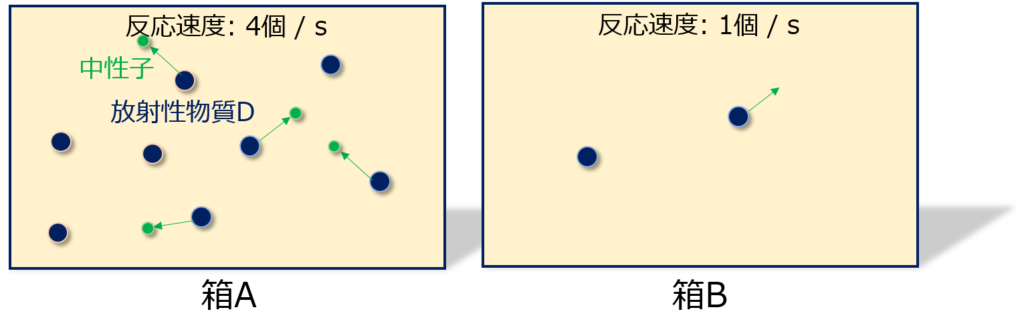 1次反応の例として、箱の中に入っている放射性物質の壊変の場合を考えます。
1次反応の例として、箱の中に入っている放射性物質の壊変の場合を考えます。
放射性物質の濃度が大きい方が、出てくる中性子(※)の数も多くなります。
つまり、「反応速度が反応物の濃度に依存」している、と言えます。
(※ 放射壊変で出てくる物質。中性子の他にβ線やγ線などを出すものもある。)
2次反応ぶ場合も同じです。反応物の濃度が大きいほうが、「衝突頻度」の関係で反応速度は増大します。
0次反応では
一方、0次反応は反応物の濃度に依存しません。
これは、かなり特殊な状況にある反応になります。
0次反応の具体的な状況
0次反応のよくある例が「触媒反応」です。
それも、ただの触媒反応ではなく、『反応物に対して触媒量が非常に少ない』状況下で起きる場合です。
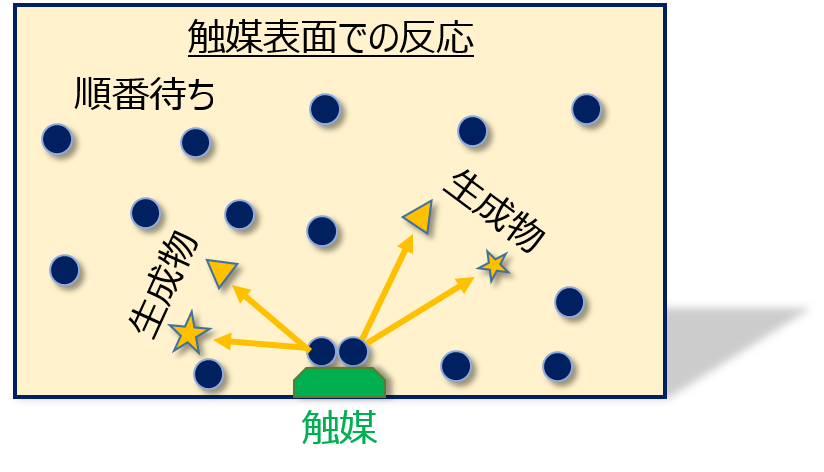
反応物はたくさんあるにも関わらず、触媒量が非常に少ないような上図↑のような状況のとき、触媒上は常に満席になっていて他の分子は「順番待ち」をしています。
既に反応物は大量にあるので、触媒が「空いた」ら即座に近くの分子が触媒に吸着します。
そのためこれ以上反応物が増えたところで、反応速度には全く影響がないのです。
反応速度は反応物の濃度に依存しておらず、触媒量に依存しています。
つまり、このような状況における反応を0次反応と呼びます。
0次反応の特徴
0次反応の発生
0次反応は、反応物の濃度ではなく、別のものが反応の律速となっている状況で発生します。
- 「反応物は大量にあって、触媒がわずかしかない」
- 「触媒はいっぱいあるが、触媒上での反応時間がそれなりに長い時間を要する」
などといった状況です。
0次反応の速度式
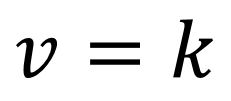
0次反応の速度vは「v=k」つまり、速度定数のみで表されます。
「反応物の濃度」が入っていないところが注目です。
この速度定数kというのは、触媒の量や触媒上での反応速度によって決まります。
単位は、モル濃度/秒 です。
重要なのは、「反応物が触媒量に対して大過剰にある」という前提です。
このような前提でのみ、0次反応は起こります。
まとめ
・0次反応は反応速度が反応物濃度に依存しない反応である。
・触媒反応が律速のときに0次反応は起こる。
・反応速度v=kで表され、反応物濃度の項がない。