『ルイス酸(Lewis Acis)』とか『ルイス塩基(Lewis base)』という化学用語って何なのか?
他のアレニウスの酸とかブレンステッドの酸・塩基とかと何が違うのか?
pHに関係あるのか?
など色々気になる疑問があると思いますので、それらについて書いていきたいと思います。
Contents
ルイス酸・ルイス塩基とは?
ルイス酸・ルイス塩基とは次のように定義されています。
| ルイス酸 | 電子対を受け入れる受容体のこと |
|---|---|
| ルイス塩基 | 電子対を与える供与体のこと |
ルイス酸とは、非共有電子対(またの名を孤立電子対、またの名をローンペアー)を受け取って安定化する側で、ルイス塩基とは非共有電子対を与えて安定化する側です。
ブレンステッドやアレニウスの酸・塩基との関係は?
『これ酸やアルカリ性と関係ある?』とまず確実に疑問に思うと思いますが、とりあえずルイス酸・ルイス塩基といはこういうものだと覚えてください・・・
酸性やアルカリ性と関係がある時もありますが、無い時もあります。ザックリ言うと、一般的な酸・塩基とは意味が異なります。後程解説します。
ルイス酸・ルイス塩基の具体例
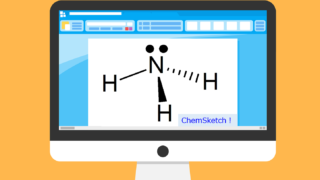
非共有電子対を持つ『アンモニア(NH3)』は典型的なルイス塩基です。
プロトン[H+]は逆に電子が抜けて空になった軌道があるので、典型的なルイス酸です。
NH3 + H+ ⇔ NH4+
という反応式は見たことあるかもしれませんが、アンモニアは非共有電子対を持ち、プロトンに『与える』ので、ルイス塩基です。逆に非共有電子対を受け入れているプロトンはルイス酸です。
ルイス酸・塩基反応が起こる理由
プロトンなどは電子が入っていない空の軌道を持つため、不安定である。
そこにアンモニアなどの非共有電子対を持つ分子が存在していると、その非共有電子対を互いに共有したほうが、熱力学的に安定となるのでルイス酸とルイス塩基は反応する。
もちろん、“モノ”によって反応性(平衡定数)は異なる。
(例えばあるルイス酸はOH–とは反応しにくいが、Cl–とはよく反応するなど。)
ルイス塩基って求核剤じゃないの?
よく勉強している人は、ルイス塩基のことを『求核剤』『配位子』『キレート剤』とよく似ていると気付くと思いますが、実はその通りで、ルイス塩基は求核剤(=配位子, キレート剤)とほぼ同義です。
違いは慣習的に、受容体は受容体でも、相手がプロトンのときにルイス塩基と呼ぶことが多いというだけです。
ルイス酸についても、求電子剤とほぼイコールです。
- ルイス酸 ≒ 求電子剤
- ルイス塩基 ≒ 求核剤
えっと、ルイス酸って『酸』なの?ルイス塩基って『塩基』なの?
最初の方で、ルイス酸やルイス塩基は一般的な酸・塩基とは意味が異なると言いました。
つまりpH試験紙の色を変化させるような存在ではないと。
理由は、ルイス酸というのは、AlCl3などのプロトン[H+]と全く関係ないものも全て含んだ概念であるからであり、同様に、ルイス塩基というのは水酸化物イオン[OH-]だけでなく、アミンやハロゲン化物イオン、アルコールなど、全ての求核性を持つ分子を含んだ概念であるためです。
一般的な酸・塩基(pH試験紙を赤や青くする存在)とは切り離された存在です。
しかし、全く無関係では有りません。
なぜなら水中にルイス酸があったとすると、やはり水素イオン濃度は大きくなるからです。(=酸性)
理由は、そのルイス酸と水溶液中の水酸化物イオン[OH–]とが酸・塩基反応をして[OH–]を消費し、水の平衡が崩れ[H+]が増大するためです。
同様にルイス塩基があった場合、ルイス塩基は[H+]と反応してしまうので、[H+]が消費され、結果[OH–]は増大します。(アルカリ性=pH試験紙を赤くする。)
まとめ
ルイス酸・ルイス塩基というのは、非共有電子対のやり取りという点で一見、従来の酸塩基の定義とは無関係に思えますが、よく考えるとアレニウスの定義やブレンステッドの定義の上位概念に位置する概念であり、水溶液中にある場合に限り、従来の定義と矛盾はありません。
疑問は解決しましたでしょうか?
ルイス酸とはいえ水に入れられると溶液は酸性に傾くし、ルイス塩基も水に入れると液を塩基性にする。