化学を勉強していると色々な概念に遭遇します。
化学の勉強をしていると、何となくギブズエネルギーって化学反応の速度と関係あるのかなあ?って思うこともあると思います。
この記事では、反応速度とギブズエネルギーの関係性を見ていきたいと思います。
ギブズエネルギーとは?
ギブズの自由エネルギー(ギブズエネルギー⊿G)は、反応が自発的に進行するかどうかを判定することのできる熱力学の重要な概念です。
ギブズエネルギーは、 ⊿G = ⊿H – T⊿S で表されます。なので、⊿H(反応熱)と⊿S(エントロピー)及びT(温度)に関係しています。
⊿Gが負のとき、反応は自発的に進行することが知られています。
なお、発熱のときは⊿Hが負であることに注意が必要です。
反応速度とギブズエネルギーは無関係
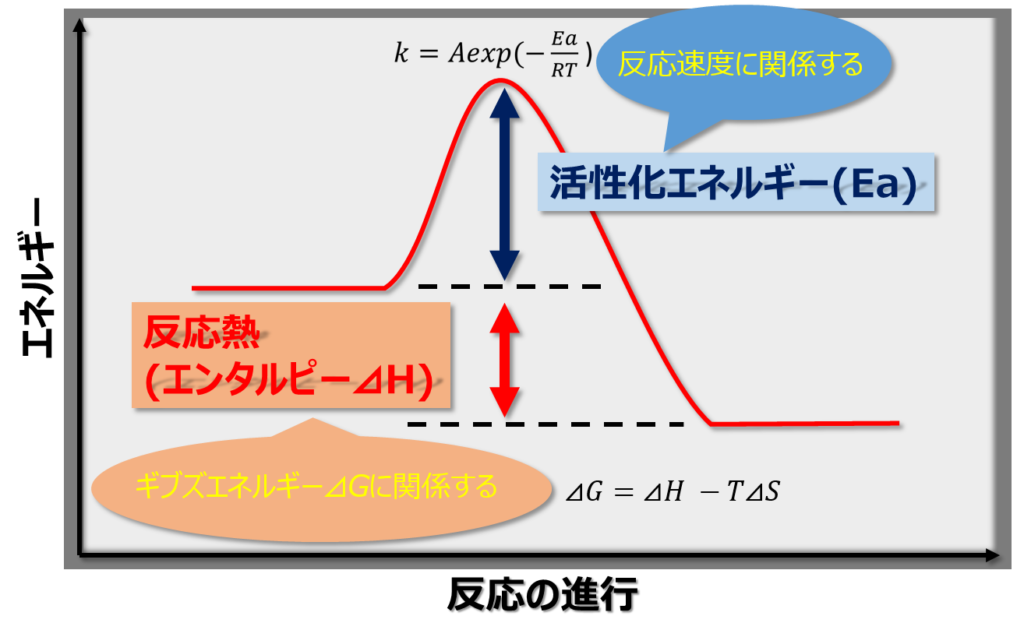
最初に言ってしまいますが、化学反応速度とギブズエネルギー⊿Gは、全く関係ありません。
自発的に反応が進行するかどうかは、⊿Hなどを使用してギブズエネルギーにより計算できますが、その自発的な反応が何万年もかかる反応なのか数秒で終わる反応なのかは計算できません。
化学反応速度に大きく影響するのは、『活性化エネルギー』です。
ギブズエネルギー( ⊿G = ⊿H – T⊿S )は⊿H(反応熱)と関係していて、発熱量が大きい方が熱力学的に安定であり自発的に反応が進みやすいということは言えますが、速度については何も言えません。
活性錯合体
発熱量(⊿H < 0)がとても大きく、エントロピー(⊿S > 0)的にもめちゃめちゃ有利な反応の場合を想定するとします。
⊿Gは非常に大きく負になってますので、反応は確実に自発的に進行します。
しかし、化学反応はまずそれ以前の問題として『活性錯合体』になることが必要です。
生成物が安定でエントロピー的に有利であっても、まずこの活性錯体にならなくてはなりません。
生成物がいくら熱力学的に安定でエントロピー的にも有利であっても、活性化エネルギーが大きければやはり反応速度は遅くなります。
理由は活性化エネルギーが高いと活性錯体になれる分子の割合がマクスウェル・ボルツマン分布に従って減少するためです。
結局、⊿Gの大きさと反応速度は基本的には何の関係もありません。
・反応速度とギブズエネルギーの大きさは無関係である。
反応速度を決める因子
例えば2分子反応( A + B → AB )の場合、反応速度は v = k[A][B]として表されます。
まず、[A][B]から分かる通り、反応速度は濃度が大きい方が速くなることがわかります。
(理由:分子同士の衝突回数が増えるため。)
アレニウスの式

次にkの部分(反応速度定数)ですが、これはアレニウスの式で記述されます。
まとめると化学反応速度に関与する因子は以下の4つです。
- 反応物の濃度
- 温度
- 活性化エネルギー
- 頻度因子(反応するために有効な分子衝突の確率)
これらによって決まります。
温度が高いと活性化障壁を超える分子が増えるため、反応速度は速くなります。
もちろん、活性化エネルギーが小さいほど反応速度は速いです。
しかし、活性化エネルギーの大小は何によって決まるか?となると、結合を切るための結合エネルギーの他、反応物と活性錯合体とのエントロピー⊿Sなども関係してくると思われます。
・反応速度の考察にはアレニウスの式が活用できる。
まとめ
- 反応速度とギブズエネルギーの大小は関係ない。
- 反応速度を考えるときは、アレニウスの式を使う。
- 詳細な議論をする際は、反応物と『活性錯合体』との関係に注目する。