有機化学ではアニオンやカチオン(やラジカル)の安定性に寄与するパラメータの一つに、『共鳴安定化』があります。
『この構造は共鳴構造を取り得るか?』を考えることによって、複雑な計算をすることなく安定性を見積もることができます。
この記事では有機化学の重要な概念である共鳴について基礎から解説します。
Contents
共鳴の基本
共鳴とは、π電子等を介した電子の行き来のことです。
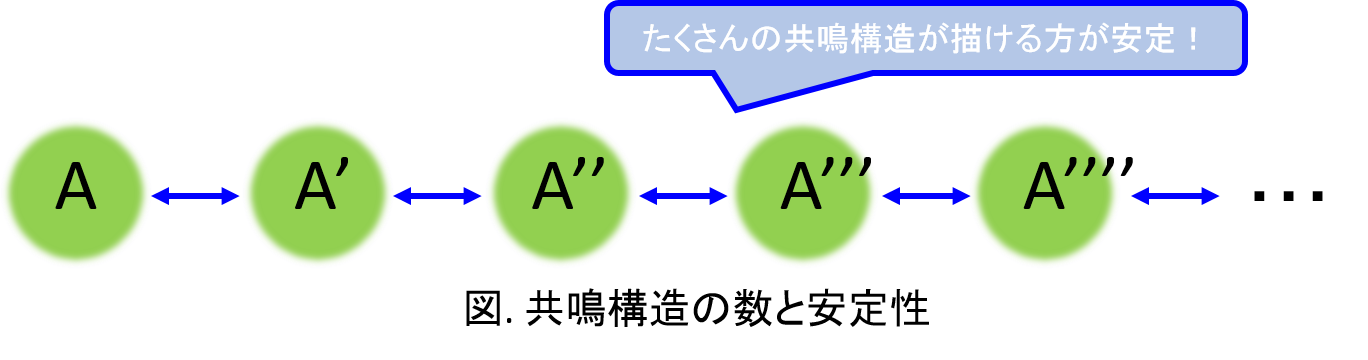
①安定な共鳴構造を②たくさん取れるほど、安定です。
二重結合に加えて、N原子やO原子、アニオンなどの孤立電子対を持っている場合にとることが多いです。
どういう時にこの考え方が必要か
例えばメタノールとフェノールどっちが酸性度が高いかわかりますか?
これを考える際、共役塩基であるメトキシドとフェノキシドの共鳴構造を比較することにより、定性的にどちらが酸性度が高いか推定することができます。
正解は後述。
ポイント①~安定な共鳴構造~
安定な共鳴構造とは?
共鳴安定化で重要なのが『安定な共鳴構造』です。
安定な共鳴構造とは、例えば酸素(O)上に負電荷が来るような構造です。
それはOは電気陰性度が高く、負電荷により安定化するためです。
そのような安定な共鳴構造をとれる(描ける)場合、安定である場合が多いと言えます。
不安定な共鳴構造とは?
逆に『不安定な共鳴構造』とは何でしょうか?
例えば炭素上に負電荷が来ている場合や、ベンゼン環の芳香族性を壊してしまうような構造です。
炭素は特に負電荷を引き付けるような特性はないですし、ベンゼン環も芳香族性が失われると安定性は下がります。
それらの構造も、『何も共鳴構造が描けないよりはマシ』な場合もありますが、安定な共鳴構造と同じレベルの安定化効果は得られません。
ポイント②~共鳴構造の数
もう一つのポイントとしては、『共鳴構造の数』です。
共鳴構造が1つしか描けないよりは2つ描けた方が、安定性への寄与は大きくなります。
しかし、ここで注意しておかないといけないことがあります。
とても安定な共鳴構造が1つとれる方が、やや不安定な共鳴構造を2つ取れるよりも安定な場合が多いと言うことです。
共鳴構造の数も大切ですが、それ以上に大事なのがその共鳴構造の安定性だと言えます。
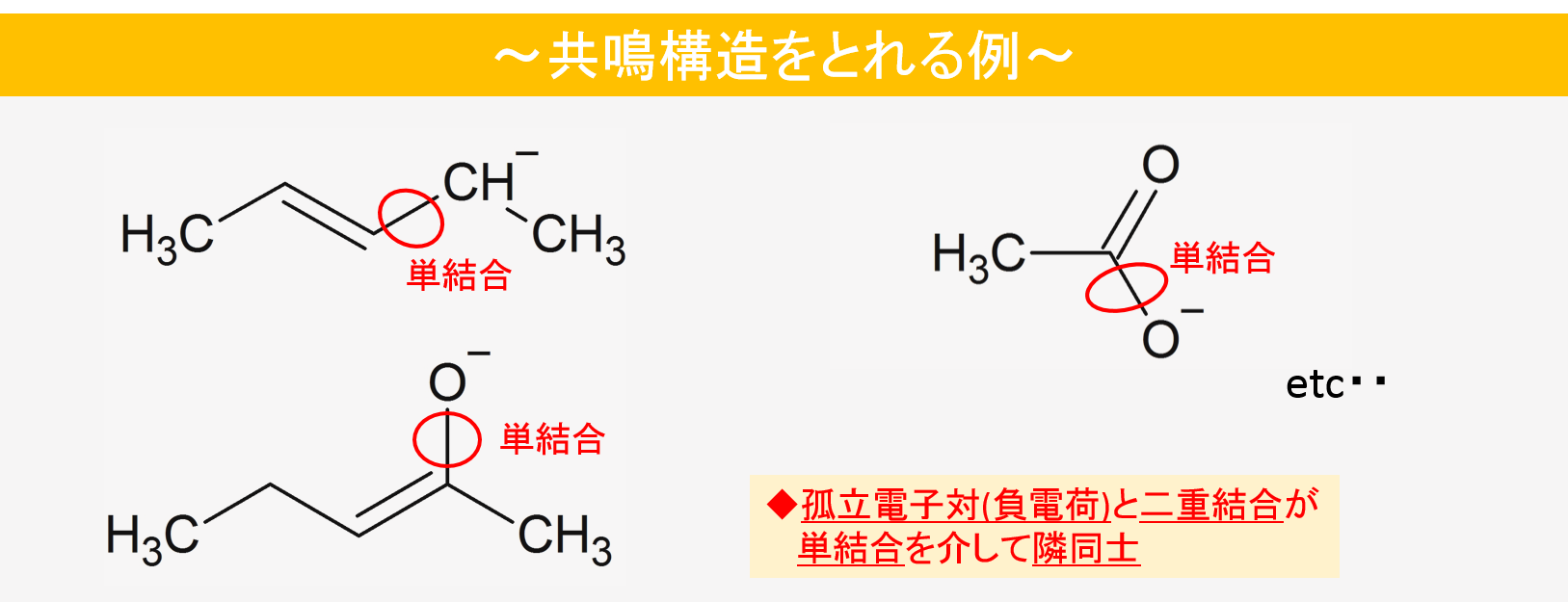
ポイント③~共鳴が起こる条件~
共鳴構造は原則として
- 孤立電子対(=非共有電子対=ローンペアー or 負電荷) or ラジカル or 正電荷 がある
- 単結合を介して二重結合が存在する
この場合に共鳴構造がとれる場合が多いです。
共鳴安定化から酸性や塩基性の強さが類推できる
酢酸とメタノール
共鳴を考えることで、例えばブレンステッド酸(プロトンH+を放出する)の強さを考えることが出来るようになります。
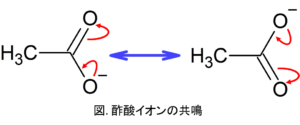
酢酸とメタノールでは酢酸の方が強い酸であることは当たり前のように知られていますが、この理由は酢酸イオンが共役安定化するためです。
酢酸イオンが安定なため、酢酸⇔酢酸イオンの平衡が右へ傾く。
しかし、メタノールのH+を放出したあとのイオンであるメトキシド(CH3O–)は、共鳴構造をとることができません。
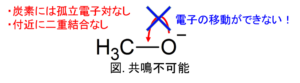
共鳴できない理由は、
- 単結合を介して二重結合がない。
ためです。
そのため、CH3OH → CH3O–の反応は起こりにくく、酸性度が低くなります。
結果、酸の強さは酢酸 > メタノール となります。
pKaの比較
・酢酸:4.7
・メタノール:15.5
メタノールだけでなく、エタノールやプロパノールも、二重結合(π電子)がないため共鳴構造を取ることができません。
という関係が共鳴と酸性度が関連する理由。
硫酸
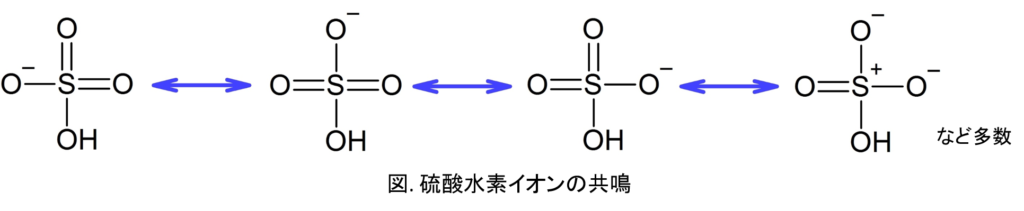
硫酸が強酸であることも周知の事実ですが、これは硫酸水素イオンが安定な共鳴構造をたくさん取れるためです。(上図)
そのため、硫酸水素イオンは安定であり、H2SO4 → HSO4– + H+ の反応が進みやすくなります。(=酸性度大)
メタノールとフェノールの酸性度比較
冒頭のメタノールvsフェノールですが、正解はフェノールの方が酸性度が高いです。
理由は、メタノールは共鳴構造をとることができない一方で、フェノールは以下に示すように多数の共鳴構造をとることができるためです。
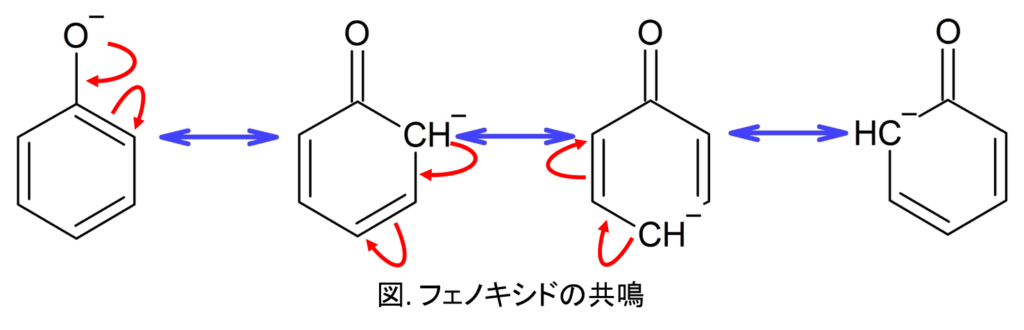
ただし、この後ろ3つの共鳴構造はベンゼン環の芳香族性を壊しているので、安定度の寄与としては小さいことに注意しなければなりません。
寄与は小さいながらも多数共鳴構造をとれるため、比較的酸性度が高くなっています。
酢酸とフェノキシドを比較すると、フェノキシドは酸性度が小さいです。
理由は、酢酸イオンは、『安定』な共鳴構造をとれためです。
共役塩基の塩基性度
酢酸イオンや硫酸イオンのように共役塩基が共鳴安定化している場合、塩基としての反応性は低くなります。(塩基性度は低い)

まとめ
- 共鳴は分子の安定性を評価するための簡便な考え方です。
- この考え方を使用して、酸や塩基の強さを類推することができます。
- 共鳴構造を取るには、孤立電子対や二重結合が適切な位置にいる必要があります。
- 共鳴構造が安定であるほど、またたくさんの数を取れるほど、その分子は安定であると言えます。