ベンゼン環は6員環のπ電子が共鳴安定化しており安定な物質として知られています。
この記事では、そんな安定なベンゼン環に対して、求電子置換反応を起こしやすくする方法に関して紹介します。
Contents
求電子置換反応とは
求電子置換反応とは、求電子剤が求核剤にアタックして起こる置換反応です。
電子不足な求電子剤(=ルイス塩基)が、電子豊富な求核剤(=ルイス酸)を攻撃することで起こります。
求電子剤はよくE+と書かれます。
重要なこととして、求電子置換反応はベンゼン環(=求核剤)に対して起こりやすい特徴があります。理由は、
- まず、ベンゼン環は電子が豊富にある。
- 加えて、ベンゼン環は二重結合をもちながら付加反応が起こりにくい。
の2つです。
なので、ベンゼン環には求電子置換反応が起こりやすいのです。
普通のアルケンでは、求電子付加反応が起こります。
なので二重結合性が薄れており、付加反応があまり起きません。
求電子置換反応を起こりやすくするには
電子供与基を利用する
ただし、ベンゼン環のみでは求電子置換反応は起こりにくいです。
(起こらなくはない。)
求電子置換反応を起こりやすくするには、電子を供与する置換基である電子供与基をベンゼン環につける必要があります。
ベンゼン環の電子密度を上げる
よく使われるのが、窒素(N:)や酸素(O:)などの非共有電子対を持つ置換基です。
これらを使うと、共鳴により非共有電子対がベンゼン環に流れ、求電子置換反応が起こりやすくなります。
(たぶん・・)
誘起効果(=超共役)を利用する
アルキル基などによる、超共役での誘起効果によっても、ベンゼン環の電子密度を上げることができます。
超共役のポイントは、『隣接する原子』に電子供与するというところです。
-CH3などは、超共役をする。隣の原子(炭素など)に電子を供与。
それによりベンゼン環の電子密度が上がり、求電子置換反応が起きやすくなります。
これは求電子剤(E+)がベンゼン環に置換反応したとしたときの共鳴構造を考えることで説明できます。
後述しますが、o-,p-位にE+が来ると、+が超共役により安定化するのが理由です。
どちらが効果が大きいか?
共鳴効果の方が、誘起効果よりベンゼン環上の電子密度を上げる効果があると言われている。
共鳴効果を発揮できる置換基をベンゼン環に導入したほうが、ベンゼン環に対する求電子置換反応は起こりやすい。
逆に、求電子置換反応を起こりにくくするには
電子吸引基の導入
電子吸引基がついていると、共鳴により置換基側に電子が流れ、ベンゼン環の電子密度が下がります。
求電子置換反応は、ベンゼン環の豊富な電子を求めて起こる反応なので、電子吸引基により電子密度が下がると、当然のことながら反応性は下がります。
ハロゲン基などによる誘起効果での電子吸引効果
ハロゲンなどもベンゼン環を不活性化します。
理由は、ハロゲンなどの『電気陰性度』の大きい置換基があると、誘起効果により電子を吸引しベンゼン環の電子密度を下げるためです。
一方で、前述のようにハロゲンは電子供与基でもあります。
電子供与基はベンゼン環を電子的に活性化させます。
なので、総合的に考えるとハロゲンはベンゼン環を活性化させます。
ハロゲンは
- 電子供与基
- 誘起効果による電子吸引性
という相反する二つの性質を持ち、どちらかというと電子供与基としての性質が勝ち、ベンゼン環を活性化させる。
求電子置換反応が起こりやすい位置
①電子供与基がついている場合
電子供与基がついている場合、求電子置換反応が起こりやすいのは説明したとおりですが、特にオルト(o-)位とパラ(p-)位で置換反応が起こりやすい。
これはベンゼン環の共鳴構造を考えると納得できる。
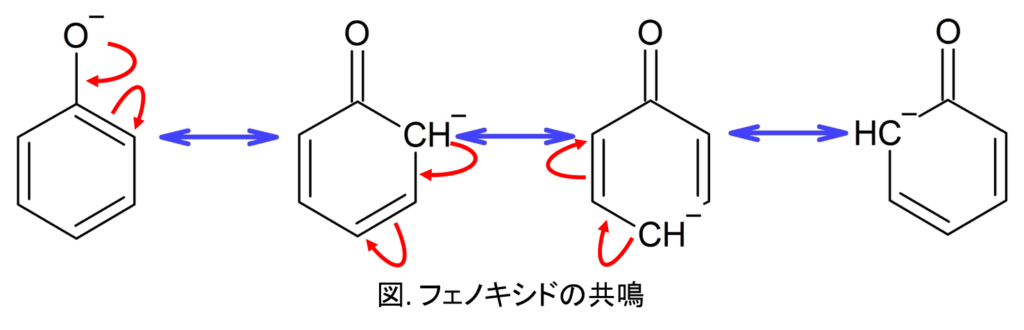
酸素イオンの非共有電子対が共鳴に参加している。
その結果、o-位とp-位には負電荷が来るが、m-位には来ない。
よって電子豊富なo-,p-位に対して、E+はアタックしにくる。
②超共役できる置換基がついている場合
共鳴構造式を描けばわかりますが、①と同様に、o-,p-位で置換反応が起こりやすくなります。
超共役はすぐ隣の原子に対して電子を供与するので、その+は安定化。
③電子吸引基がついている場合
前述のように、本来は電子吸引基があると求電子置換反応は起こりにくくなります。
しかし、起こるとしたらメタ(m-)位で起こります。
これも、ベンゼン環の共鳴構造を考えると納得できます。
④誘起効果による電子吸引性を持つ置換基がついている場合
前述のように、ハロゲン(-F, -Cl, -Br, -I)がベンゼン環に直接結合していると、電子吸引性の誘起効果により求電子置換反応が起こりにくくなります。
しかし、起こるとしたらメタ(m-)位で起こります。
これも③と同様に、ベンゼン環の共鳴構造を考えると納得できます。
求電子置換反応の良い所
アルキル基を導入できる
有機化学の大きな目的の一つが、分子の炭素数を増やすことです。
酸化などで酸素(O)が導入されることは自然界でも勝手に起こりますが、炭素鎖が伸長することは、めったにありません。
自然界であるとすれば、オレフィン類の重合ぐらいでしょうか?まだまだある?
求電子置換反応の一種である、フリーデル・クラフツ反応により、ベンゼン環に炭素鎖を導入できる。
代表的な求電子剤
芳香族求電子置換反応を起こしやすい、代表的な求電子剤は以下のものがあります。
ハロゲン化アルキル
R-Xの形の脂肪族化合物。
ハロゲンが脱離することで、R+になり、強力な求電子剤となり得る。
ルイス酸触媒とセットで使用される。
RXのハロゲンXが、電子不足のルイス酸に電子を供与する形となる。
その結果、アルキル基がプラス性を帯び、カルボカチオンとなることで求電子剤となる。
フリーデル・クラフツ反応
アシル化合物
アシル基(R-COH やR-COClなど)をもつ化合物のこと。
特にハロゲン化アシルは、アシリウムイオンを生じるので、強力な求電子剤となる。
フリーデル・クラフツ反応
ハロゲン
ルイス酸触媒存在下で、ハロゲンが求電子剤として働く。
例えば、臭素(Br-Br)の場合、σ結合の電子雲がルイス酸触媒に引き寄せられ、電子の一部を配位するような形になる。
その結果、Br-Brの電子雲が、プラスとマイナスに偏る。
それによって生じたプラス部分がE+として電子豊富なベンゼン環にアタックして、求電子置換反応が起こる。
濃硝酸(ニトロ化合物)
濃硫酸との混合により、にニトロニウムイオン(NO2+)を生じるが、これが求電子剤として働き、ベンゼン環に対して求電子置換反応を行う。
スルホン酸
濃硫酸やSO3も求電子剤として働く。
発煙硫酸(濃硫酸とSO3の混合物)をベンゼンと反応させると、求電子置換反応によりベンゼンスルホン酸が得られる。
プロトン
プロトンも水の平衡定数が示す通り、強力な求電子剤である。
(OH–と結合したほうが圧倒的に安定。)
ベンゼン環のHが置換反応を起こしたとしても、見た目上同じなのでわかりにくいが、プロトンも求電子置換反応は起こす。