化学反応速度には反応速度定数がでてきたり、アレニウスの式やマクスウェル・ボルツマン分布がでてきたり、活性化エネルギーが出てきたり、色々な概念がでてきますが、反応速度を理解する上でまず一番大事なのは、『濃度』であると思います。
濃度の濃い薄いで反応速度が変化するということを理解することは基本中の基本ですが、意外と理解できていない場合が多いです。
濃度と反応速度の関係が分かれば、反応速度の理解は深まります。
なので、この記事では濃度を中心に反応速度を見ていきたいと思います。
高濃度ほど反応速度は速い
化学反応はたいてい分子Aと分子Bが衝突することによって分子Cになることで起こります。
A + B ⇔ C
反応速度の解析ではCの生成速度 d[C]/dt により反応速度を求めます。
その場合、反応分子である分子Aと分子Bがたくさんあったらそれだけ反応速度は大きくなります。
そして、注意しなければいけないのが、ただ沢山あったらいいわけではなく、『単位体積当たりに分子Aと分子Bがたくさんあったら』反応速度は大きくなります。
狭い箱の中に反応原料である分子をたくさん入れてあげると、反応速度は上がりますが、量的には反応原料がたくさんあっても、反応の場がとてつもなく大きかったら、反応速度は小さいです。
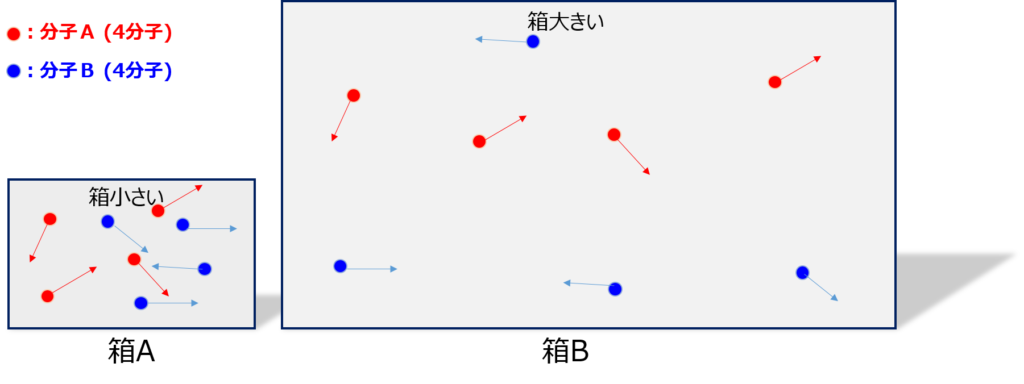 このように、箱Aと箱Bには分子Aと分子Bが同じ数だけ含まれていますが、どう考えても箱Aの方が混んでいるのでよく衝突しそうだし、箱Bはスカスカなので衝突頻度が低そうに思うと思います。
このように、箱Aと箱Bには分子Aと分子Bが同じ数だけ含まれていますが、どう考えても箱Aの方が混んでいるのでよく衝突しそうだし、箱Bはスカスカなので衝突頻度が低そうに思うと思います。
化学反応はよく交通事故に例えられます。
車の数がいくら多かろうと、広大な敷地を走っている分には時速100kmで走ろうと接触事故の確率は低いですが、街中を時速100kmで飛ばしていると間違いなく接触事故を起こします。
化学反応は分子の衝突によって起こるので(1次反応である放射壊変など以外)、反応速度に関わってくるのはmol数ではなくmol濃度ということになります。
温度を上げたらどうなるか?(衝突頻度)
知っている人も多いかもしれませんが、温度を上げると分子の運動が激しくなります。
車で言うと、速度が上がります。
そうなるとどうでしょうか。
今まで時速100kmで走っていたところを、時速200kmで走るようになると、衝突頻度が上がりそうではないでしょうか?
その通りで、温度を上げることで分子運動が大きくなり、衝突回数が増えるため、反応速度は増大します。
温度を上げたらどうなるか?(活性化エネルギー)
これは濃度とは関係ありませんが、温度を上げたら反応速度が上昇する理由の2つ目が、活性化エネルギーを超える分子が増えるからです。
反応が起こるには活性化障壁を超えなけれないけないことはよく知られていますが、温度を上げるとその分、分子の運動エネルギーが増大するので、活性化障壁を超えやすくなります。
車の例で言うと、速度が時速100kmの場合と時速200kmの場合では、ぶつかったときの衝撃は全然違いますよね。
反応は衝突したときのエネルギーが大きいほど起こりやすいので、温度は反応速度を増加させます。
1次反応も濃度に依存する
先ほどの例は、2分子反応の場合でしたが、1分子反応の場合も濃度が重要なことには変わりません。
放射性物質の放射壊変は1次反応で、特に衝突によってではなく、1分子で自己完結的に反応が進みます。
しかしその場合でも、反応速度には濃度が関係します。
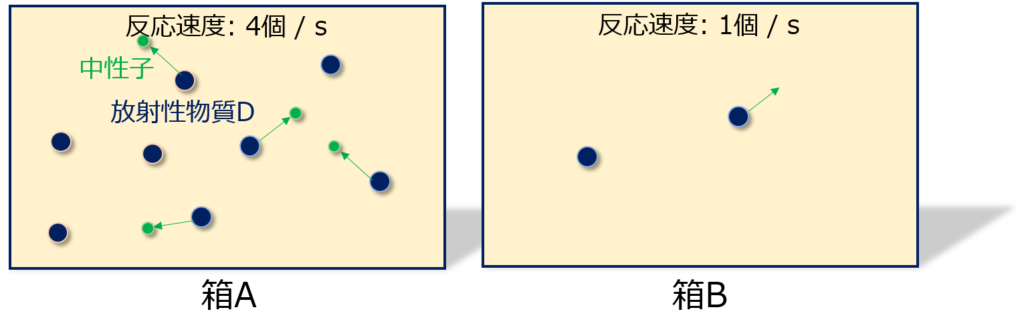
上の図で、箱Aと箱Bは同じ大きさで、箱Aには放射性物質Dを8個、箱Bには放射性物質を4個入れました。
この放射性物質Dは1秒間で1/2の確率で放射能を出して壊変するとします。
すると、箱Aでは反応速度は4個/秒であり、箱Bでは速度は1個/秒となります。
当然、たくさんDが入っている箱Aの方が反応速度が速いです。
(『反応』というとどうしても2分子が出会う場合をイメージしやすいですが、1分子反応も立派な反応です。)
速度定数との関係
『ちょっと待てよ!反応速度って1秒間に1/2の確率で壊変するこの速さのことじゃないの!?』
と一瞬思う人もいると思いますが、これは速度ではなく、『速度定数』です。
反応速度:v = k[D] のkの部分が、この1秒間に1/2で壊変するという情報に当たります。
『壊変速度』とでも言いましょうか。
あくまで反応速度というのは、1秒あたりに生成する生成物(ここでは中性子)の濃度であるわけです。
中性子を生み出す親である放射性物質Dがたくさんいた方が、反応速度:d[中性子]/dt は大きくなります。
これが反応速度です。
蛇足ですが、2分子反応の速度定数は2分子の衝突の頻度が入ってくるのと、有効な衝突確率という概念も含まれますが、1分子反応は『壊変の確率』であるので、同じ速度定数と言ってもだいぶ性質が違うのがわかります。
・1分子反応も2分子反応も、『濃度』が反応速度に影響する。
・反応速度とは生成物の発生速度である