pHメーターがどういう原理で測定しているのかを、ざっくりと解説したいと思います。
pHメーターは日常的に使っている人も多いと思いますが、奥が深いツールです。
なぜ『水素イオン濃度だけ』選択的に検出するのかなど、興味がそそられます。
この記事では、細かい理屈(ネルンストの式など)は抜きにしてpHメーターの外観を捉える目的で書いています。
ガラス電極が重要
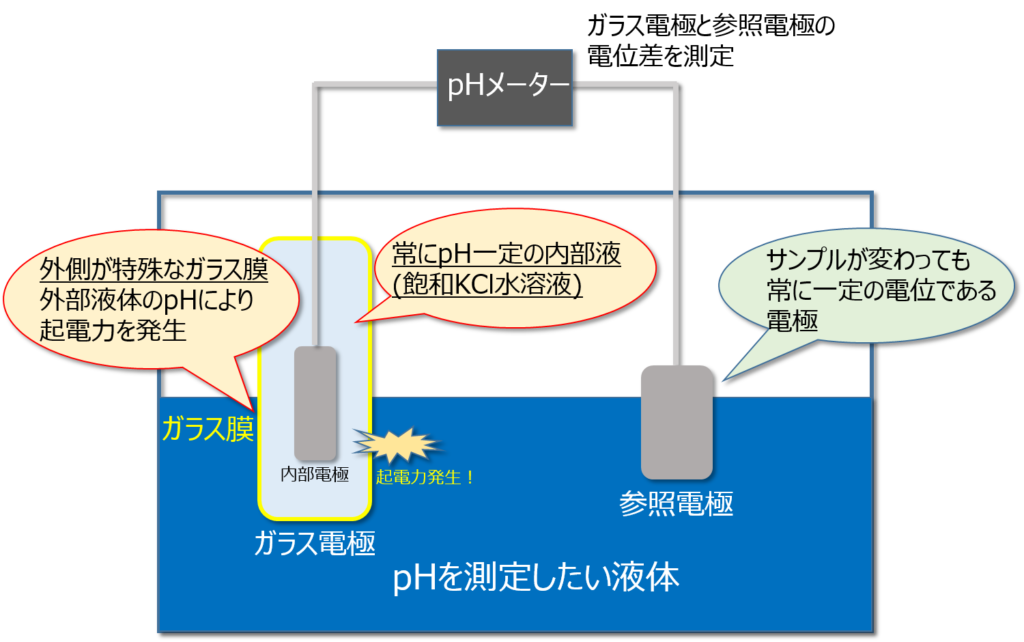
起電力の発生によりpHを測定
ざっくり説明すると、ガラス電極の内部と外部でpH差がある場合に起電力が生じるため、その電位を測定することでpHを測定することができます。
もう少し詳しく説明します。
pH測定の要であるガラス電極
pHメーターは『ガラス電極』が使用されています。
そのガラス電極のガラス膜の部分で、水素イオン濃度に応じた起電力が発生します。
ガラス電極の内部は飽和KCl溶液が入れられていますが、pHが7になるよう一定に保たれています。
そのようなガラス電極を、それ以外のpHである外部液に浸した時に起電力が発生するという仕組みです。
それは特殊なガラス膜を使用していることで可能となっています。(ガラスなら何でもいいわけではありません。)
外部液のpHと内部液のpHが1違えば、起電力が約60mV発生します。(参照電極との電位差)
それを読み取ることで、pHを計算しています。
ガラス電極内部には、ガラス膜で発生した起電力を参照電極に伝えるために『内部電極』も備え付けられています。
安定な参照電極
一方、参照電極の方はというと、どんな液体に漬けても絶えず一定の起電力となるような安定な電極システムを使用しており、ガラス電極の起電力変化のみをpHメーター全体では検出するようにしています。
ガラス膜の電位変化(外部液のpH)のみを検出する仕組みとなっている
ガラス電極がpHに応答するのはなぜ?
しかしそもそも、何故ガラス膜は内部と外部の溶液の水素イオン濃度の差を感じ取って、起電力を発生させるのでしょうか。
一説にはガラス電極表面の水和層にあるシラノール基(SiOH)が、水素イオンと極めて選択的に平衡反応
SiOH ⇔ SiO– + H+
を起こし、『H+が移動する一方で、同時にLi+が逆に移動する』ことで起電力を生じるという説明があります。
また一説には、『ガラス内を水素イオンが拡散する』ことで、起電力を発生させるというものがあります。
しかし反論もあるなど、その詳細なメカニズムは未だ完全にはわかっていません。
1906年に、M.Cremerがガラス膜で隔てられた両液相間で、起電力が発生することに偶然気付いたところから始まったとされます。
まとめ
pHメーターの仕組みを理解するためには、ガラス膜の部分で起電力が発生することを抑えればOKです。
細かい理屈を知るためには電気化学の教科書を熟読しなければなりません。
ただし、ガラス電極で起電力が発生する本質的な部分の解明はまだ為されていないので、『そういうものか』ぐらいの気持ちで読むといいかもしれません。