反応速度って化学を勉強しているとよく聞く単語だと思いますが、反応速度は何によって決まるかご存知でしょうか?
反応速度に最も密接に関係しているパラメーターは活性化エネルギーです。
そこで、この記事では化学反応速度と活性化エネルギーの関係を見ていきたいと思います。
また、アレニウスの式や、マクスウェル・ボルツマン分布や、エンタルピー、ギブズエネルギー等についても述べたいと思います。
Contents
活性化エネルギーと反応速度
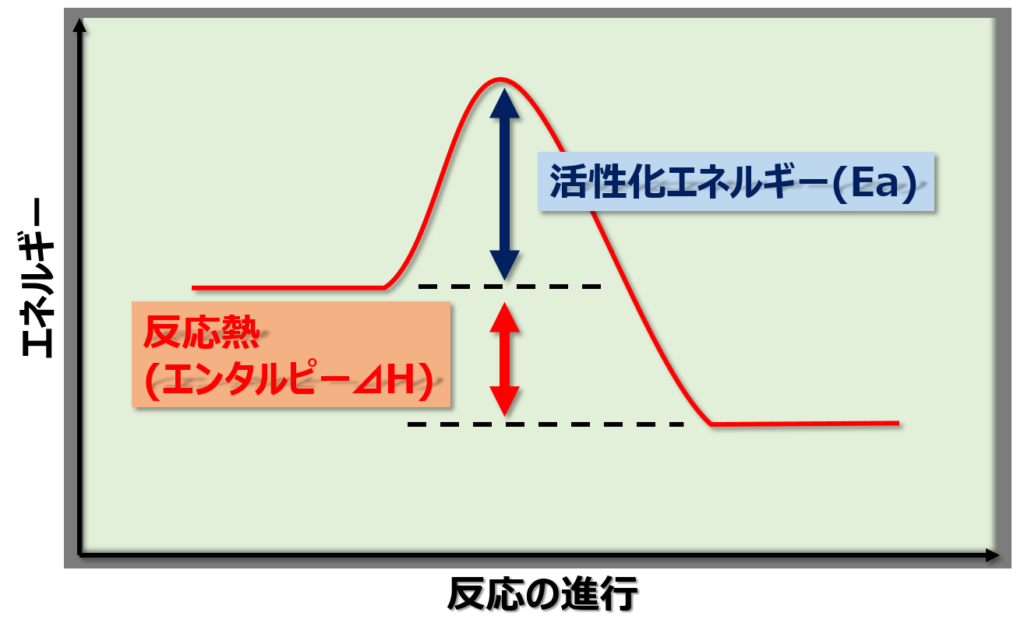
上の図は、化学をやってたら高校の時から見飽きるぐらい見たかと思いますが、活性化エネルギー(Ea)とは反応が進むのに必要なエネルギーのことです。
具体的にどういうことか見ていきます。
反応速度が活性化エネルギーと関係する理由
化学反応が起こるには、分子同士が『衝突』し、その時に発生するエネルギーが活性化エネルギー(Ea)を越える必要があります。
例えば H2 + I2 ⇔ 2HI というよくある反応についてですが、水素分子H2とヨウ素分子I2が反応してヨウ化水素(HI)になるには、H-H結合とI-I結合を切らないとH-Iにはなれません。その時にエネルギーが必要だというのは何となくイメージできるかと思います。
(注:ただし活性化エネルギーはH-H結合エネルギーとI-I結合エネルギーの和にはなりません。活性錯合体という状態を経るため。)
・活性化エネルギーが小さいと、衝突した分子は余裕で活性化エネルギーを超えるので、出会ったそばから反応するでしょう。( = 反応速度は速い)
・逆に活性化エネルギーがとても高いとどうなるか。分子同士が衝突しても、エネルギーが足りず、反応は一向に進みません。( = 反応速度は遅い)
『触媒』を使用したら活性化エネルギーが下がって反応が反応速度が上がるという話も、聞いたことがあるかもしれません。
温度との関係
分子は並進運動や回転・振動などのエネルギーを持っています。
温度が高いとそれらの運動エネルギーが大きくなります。
そのため、温度が高いと分子同士が衝突した際にエネルギーが大きくなり、活性化エネルギーを超えやすくなります。
なので、温度が高いと反応速度は上がります。
( = 反応速度に温度が関係する。)
(ちなみにある温度での分子のエネルギー分布については『マクスウェル・ボルツマン分布』で語られています。温度が高いと、マクスウェル・ボルツマン分布に従って、エネルギーの大きい分子の割合が増えます。そのため、衝突の際に活性化エネルギーを超えるだけのエネルギーを持った分子の割合が増えるので反応速度は上がります。)
・活性化エネルギーの大小が反応に影響する。
・温度が高いと活性化エネルギーを超えやすくなり反応速度は上昇する。
反応熱(反応エンタルピー⊿H)は反応速度に影響するか?
反応熱の大きさは、反応速度に全く影響しません!
確かに反応熱が大きい方が生成物は『安定』です。
しかし、そのことと反応速度には一切関係がありません。
生成物は非常に安定であったとしても、その反応が起こるための活性化エネルギーが大きかったり、あるいは『立体障害』などで有効な衝突が非常に起こり難かったりすると、反応は起こりません。
また、ギブズエネルギー⊿Gと反応速度も無関係です。
この辺りは勘違いしやすいところです。
アレニウスの意味
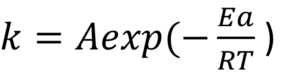
反応速度定数
よく、 A + B ⇔ C の2次反応の反応速度式が、v = k[A][B] で表されるのを見ることがあると思います。
まず、濃度[A][B]が関係しているのは、濃度が大きいと衝突する機会が増えるので、当然関与してきます。
で、速度定数kがアレニウスの式によって、求められます。
アレニウスの式とは
アレニウスの式は化学反応の反応速度を記述する式です。
アレニウスの式には反応速度に関わる全ての因子が考慮されています。
反応には、『活性化エネルギー(Ea)』『温度(T)』が重要と言いましたが、まずその二つは式に入っています。
そして、Aというパラメーターもアレニウスの式には入っています。
アレニウスの式のAの部分は『頻度因子』と言われており、先ほどチラッと立体障害について言及しましたが、このAは反応が起こる際の分子の構造に関係したパラメーターです。
反応が起こるためには、分子同士が適切な角度で衝突しなければ起こりません。
もし立体障害などがあると、反応が起こるための角度というのが、非常に狭くなります。
(つまり、本当にちょうど良い角度で衝突しなければ反応が起きないことにない。そのため有効な衝突の確率が小さくなり、反応速度が下がる。)
逆に立体障害などがなく、どの角度から衝突しても反応が起こる場合、Aの値は大きくなります。( = 速度定数kが大きくなる。)
活性化エネルギーなど、反応速度『定数』に関係する全てのパラメーターがアレニウスの式で考慮されている。
まとめ
反応速度と活性化エネルギーの大小は密接に関係しており、活性化エネルギーのデータを見て反応速度が速いか遅いかを推測することが出来ます。
一方で、反応速度は活性化エネルギーのみでは決まらず、濃度は当然のことながら、温度や頻度因子によっても影響され、それはアレニウスの式に記述されています。
アレニウスの式は反応速度を研究する際には、『必ず』使われる有名な式で、企業などでは材料の劣化速度を予測する際にアレニウスの式が利用されたりします。















