アレニウスの式はK=Aexp(-Ea/RT)で表され、反応速度定数と活性化エネルギーなどの関係を示す便利な式です。
大学では『化学反応論』の講義で必ず取り上げられ、分子の衝突などと絡めて、詳しく学ぶことになります。
アレニウスの式はAの部分が『頻度因子』と言われている通り、何となく2分子反応の衝突理論を意識しているように思われますが、この式は2次反応だけでなく、1次反応でも適用できます。
1次反応における『頻度因子A』の意味
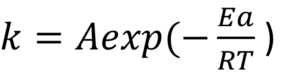
もともとは2次反応のための式
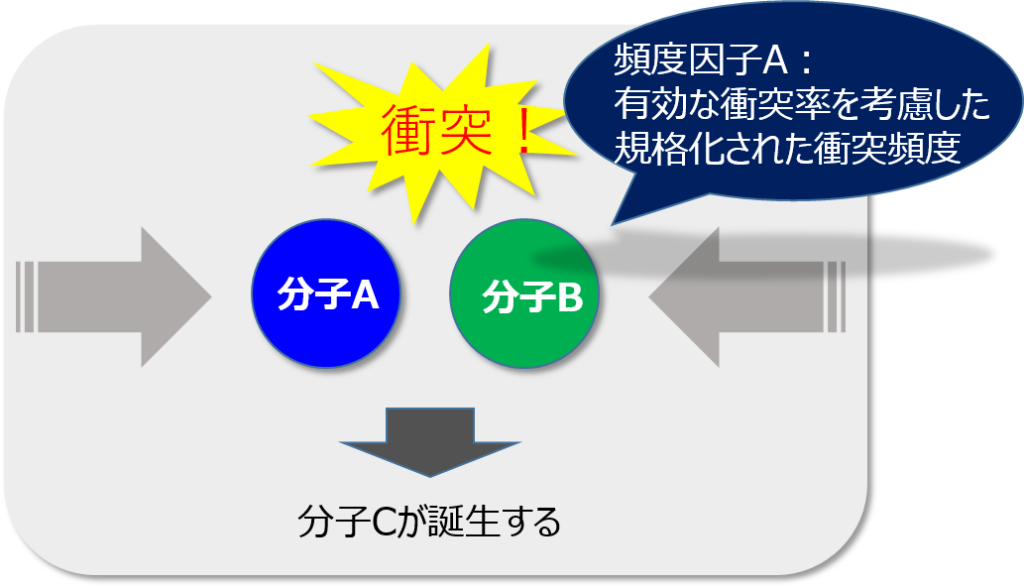
アレニウスの式の頻度因子Aは、2分子反応が分子の衝突による活性化によって起こるという『衝突活性化説』における、『反応に有効な衝突の頻度』を盛り込んだ概念であるので、もともと2分子反応を対象としていたと思われます。
1分子反応における衝突頻度A
しかし、実際は『分解反応』や『受容体からの酵素の離脱』のような1分子反応においても適用可能です。
ただ反応メカニズムが全く異なるにも関わらず、同じアレニウスの式を使用しているので、頻度因子Aの物理的解釈というのは1次反応と2次反応で異なります。
頻度因子Aの解釈
2分子反応
『2分子の衝突頻度Z』と『有効な衝突角度の割合(立体因子)P』を掛け算したものです。
頻度因子A = PZ
例えば、H2+I2 → 2HIの例では、衝突頻度Zがだいたい4×10^10 ~ 10^11 L/mol・sぐらいで、立体因子Pが0.28と求められています。
ただしこれは実験による経験的な値である。(理論的な計算で求めらモノではない。)
1次反応
『分解』や『脱離』などが典型的な反応ですが、『分解』反応の代表的な例が『過酸化水素の水と酸素への分解』や『セシウム137の放射壊変』などで、『脱離反応』の典型例が『細胞表面の受容体に結合したリガンドの脱離』などです。
『分解』も『脱離』も、周囲に存在する『溶媒』による衝突が一つのドライビグフォースであるので、溶媒の誘電率や立体構造、極性などに依存した定数になると推測されます。
触媒のパフォーマンス
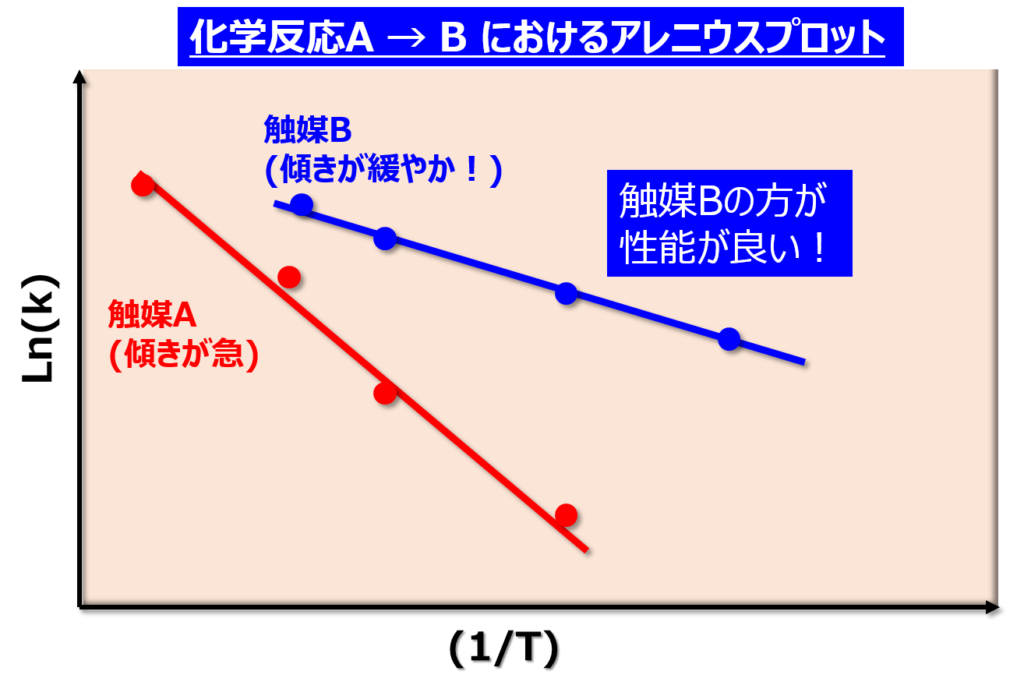
1分子反応や2分子反応に関わらずですが、アレニウスの式は触媒の効果を調べるのに使用されます。
活性化エネルギーEaはアレニウスプロットにおいて、傾きが急であるほど大です。
触媒は『活性化エネルギーを下げるほど効果的』であるため、傾きが緩やかな触媒Bの方が、パフォーマンスに優れていることが調べられます。
まとめ
・1次反応にもアレニウスの式は使える
・頻度因子Aの解釈が1次反応と2次反応で異なる。














