化学反応次数を決めるのは実は難しいことです。
2N2O5 → 2N2O4 + O2
の化学反応式を見ると、一件化学式からはN2O5の2分子衝突によって進行する『2次反応』に見えます。
しかし、実際は多段階で反応が進行し、全体の反応速度式は1次反応で表されます。
(化学式の情報と違う!)
1次反応で進む理由
☆ 2N2O5 → 2N2O4 + O2 ・・全体反応
この化学反応は一見、2次反応に見えます。
つまり2分子の五酸化二窒素(N2O5)が、お互いに衝突することによって化学反応が起こる反応です。
一見したところ、反応速度は、v = k[N2O5]^2 の2次式で表されそうです。(kは速度定数)
しかし、実際は1次反応なのです。v = k[N2O5] なのです。
何故でしょうか?
実はこれは、①反応が多段階で進むことと、②N2O5の反応が律速となる反応であるという2つの事実が関係しているからです。
反応が多段階である
まず、この反応が多段階であるという事実を説明します。
2N2O5 → 2N2O4 + O2・・☆
という反応は
①N2O5 → N2O3 + O2
②N2O3 → NO + NO2
③N2O5 + NO → 3NO2
④2NO2 → N2O4
という4段階で進行します。
まず五酸化二窒素(N2O5)は、1次反応により分解して、三酸化二窒素(N2O3)と酸素(O2)を生成します。(反応①)
N2O5の分解反応が律速である
そして重要なことは、この反応①が一連の反応の中で最も時間がかかる、律速段階にある反応なのです。
反応②~④の反応速度というのは、反応速度①と比べて十分速く、反応速度に影響を与えません。
(②~④の合計の反応速度が反応①より速ければ、反応速度は①の速度に完全に一致する。)
なので、全体の反応が(N2O5)の分解反応に近似され、1次反応となります。
全体の反応速度式
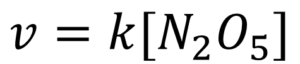
結局、全体の反応速度式は、上記のようになります。
でも、こうなることは実験的に調べないとわかりません。
また、実は活性錯合体の段階で2段ある反応などもあり、やはり実験しなければ化学反応の次数というのは決めることができないのです。
つまり本当は、『反応式から反応次数を決定することはできない』が実際のところです。
(高校までは係数と次数が一致していることが多かったと思います。)
反応式から反応速度の次数を決定することは、本当はできない。
まとめ
・一見2次反応に見える反応でも、実際は1次反応であることがある。
・理由は①反応が多段階 であることと、②律速反応が存在 するため。
・化学反応が何次式なのかは、実験事実から初めてわかる。














