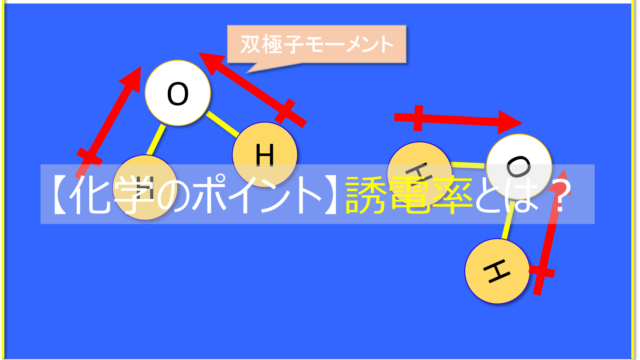
『求電子剤』とは、電子的に不足している部位を持った分子のことです。
カチオンだったり、一部がδ+だったりします。
電子受容体なので『ルイス酸』とほぼ同義です。
アルドール縮合やマイケル付加などの、炭素-炭素結合を生成する反応に使われるのが有名ですが。しかし、それ以外にも至る所で求電子剤は登場します。
Contents
求電子剤の特徴
求電子剤は、その名の通り『電子』を求めている剤(分子)になります。
求電子剤は、何らかの原因で電子不足に陥っている部位を持った化合物であり、電子を求めて様々な反応を起こすという特徴があります。
専門的には、ルイス酸性の高い分子が求電子剤に分類されます。
例えば以下のような場合が典型的です。
近くに電気陰性度の高い原子がある
電気陰性度の高い原子、例えば酸素(O)などが結合している炭素などは、電子がひっぱられるので電子不足(δ+)に陥っています。カルボニルが最も有名です。
カルボニル炭素が、求電子剤として様々な反応を起こします。
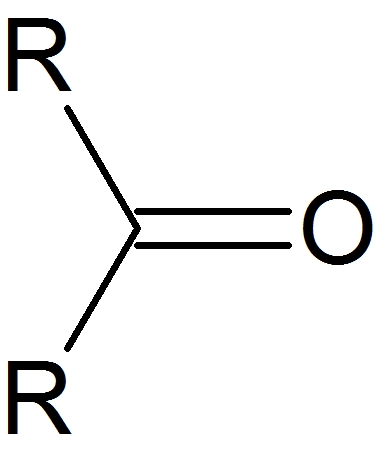
このカルボニル炭素と求核剤が反応して、新たな結合が生まれたりします。
電子吸引性の脱離基が存在する
脱離基が結合している化合物も、求電子剤になりやすいです。
例えば、ハロゲン化アルキルなどがそうです。
![]()
塩素(Cl)は電気陰性度が高く、電子供与性が小さいので、良い脱離基です。
脱離してCl–となり、アルキル基はR+になります。
このR+は非常に不安定なので、電子を求めて反応しようとします。
つまり良い求電子剤です。
電子を欲しているとは?
例えば+性を帯びていても、電子を欲していないと求電子剤にはなれません。
つまり、何らかの原因で+性が安定化してしまうと求電子剤としては弱いです。
例えば、
- 共鳴構造により+電荷が安定化される
- 近くにアルキル基などの電子供与基がありδ+が安定化される
などの場合は、求電子剤としての性質が弱まります。
とは言え、これらも程度問題で、完全に求電子性がなくなることは有りませんが。
求電子剤の登場する場面
- アルドール縮合
- マイケル付加
- 求電子付加反応
- 求電子置換反応
しかし、これらに限らず求電子剤的な考え方の反応は至るところに登場するため、重要です。
求電子剤の例
プロトンH+
一番単純な求電子剤です。
水の平衡定数が示す通り、かなり強力にOH–と結合します。
アルキルカチオン
R+は非常に不安定で、良い求電子剤です。
ハロゲン化アルキルのハロゲン脱離後などR+になります。
カルボニル炭素
C=O結合のCの部分は、電子不足のδ+性があり、求電子剤としての働きがあります。
α,β-カルボニル化合物の1位の炭素
マイケル付加で登場する、α,β-カルボニル化合物の1位の炭素は、カルボニル炭素よりも強い求電子剤です。(酸 or 塩基性溶液中で)
金属イオン
Cu2+やFe3+などの金属イオンはカチオンであり、求電子剤が多いです。
OH–などの電子豊富なアニオンや、アミンなど非共有電子対を持ったキレート剤と結合します。
ハロゲン
Br-Brなども、触媒とともに使用することで求電子剤になり得ます。
詳しく述べませんが、Br-Brの片方に電子が偏り、Br+とBr–のような状況が生まれ、Br+が求電子剤として働くのです。
まとめ
求電子剤は電子不足な部位をもった化合物と思っておけば間違いないです。
何らかの原因でカチオンになった炭素(R+)や、電気陰性度の高い元素が隣にある影響でδ+性を帯びた炭素などが、典型的な求電子剤です。
プロトンや金属イオンなども実は求電子剤であり、探せば無数に求電子剤は存在します。
Na+などはルイス酸性が小さいため、あまり求電子剤とは呼ばれません。
+性を安定化させるような置換基が付いている場合なども、求電子剤にはなりにくいです。