アルデヒド(R-CHO)は、α水素が脱離しやすいため少し酸性を示します。
強度としては、アルコールに迫るぐらいのpKaとなっています。
pKaが低い = (ブレンステッド)酸性が強い
スポンサーリンク
Contents
アルデヒドはα水素の脱離でブレンステッド酸性を示す
アルデヒドとα水素
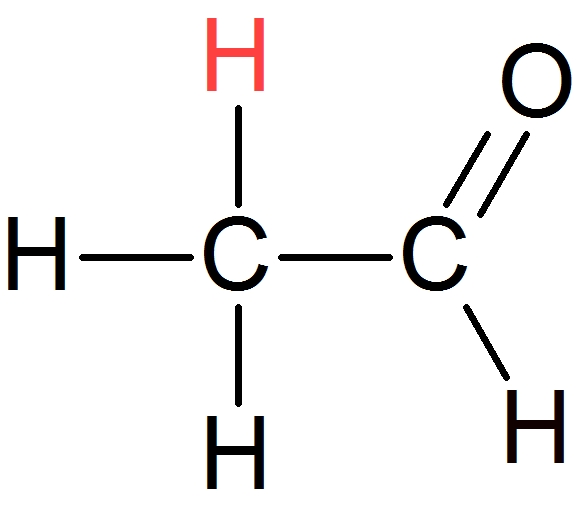
アルデヒドは、カルボニル炭素がδ+に帯電しており、ルイス酸であることは有名ですがが、全体で見るとある程度のブレンステッド酸性も示します。
(そのためアルデヒドはpKaがまずまず低い。)
理由は、アルデヒドのα位の水素が脱離しやすいことに起因します。
α水素が脱離しやすい理由
- C-H結合の共有電子対がOに引き寄せられる
- 脱離後のアニオンが共鳴構造により安定化
この①と②の効果によりアルデヒドのα水素は脱離しやすく、だいたいアルコールぐらいにはpKaが低くなっています。
| 構造 | 化合物名 | pKa |
| CH3CH2CH3 | プロパン | ~50 |
| CH3CHO | アセトアルデヒド | 17 |
| CH3CH2OH | エタノール | 16 |
| CH3COOH | 酢酸 | 4.76 |
プロパンと比較すると、アセトアルデヒドはかなり酸性度が高い。
pKaが低い理由①(酸素の電気陰性度)
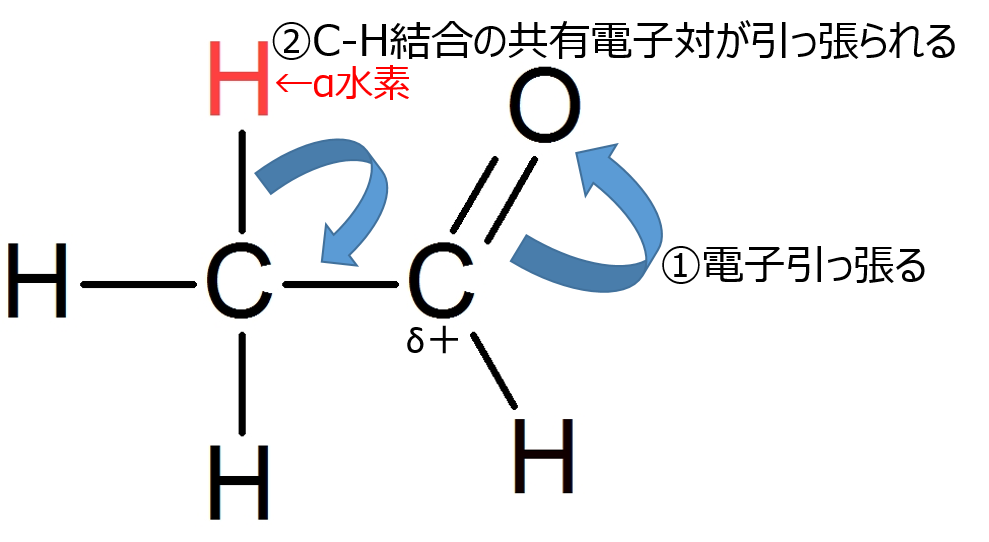
- カルボニル基の酸素は電気陰性度が高いため、二重結合の電子を引っ張る
- するとカルボニル炭素はやや電気的に+になる
- そのため、電子を引き寄せようとしてC-H結合の共有電子対を引っ張る
考え方としてC-C結合の共有電子対が引っ張られないのは、結合が強固なため、開裂するような電子の引っ張られ方はしないためと思われる。
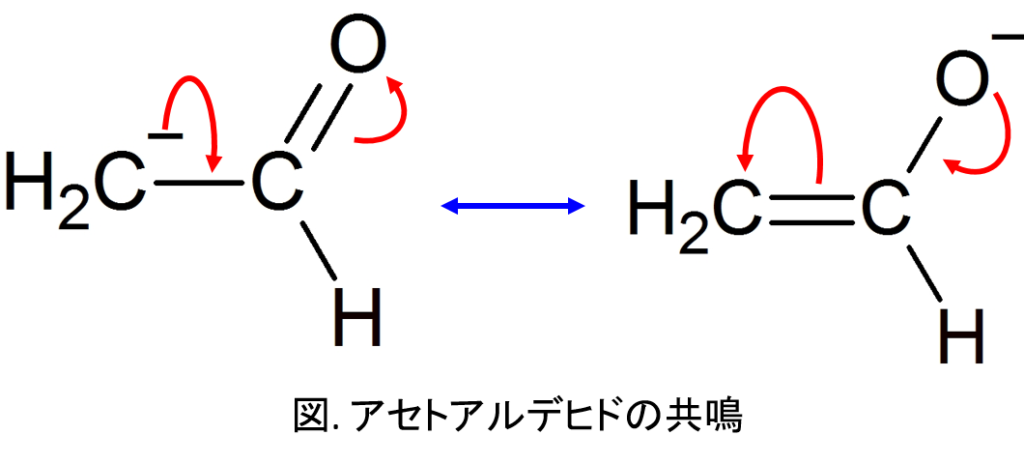
pKaが低い理由②(安定な共鳴構造)
α水素が脱離した場合にのみ、共鳴構造による安定化を受けます。
マイナスの電荷がOの上にあるという、安定化の寄与を受けられる共鳴構造を取れる。
アルデヒドのα水素はプロトンとして脱離しやすい!
ケトン基を持つ化合物全般に言える
アルデヒドだけじゃない!
アルデヒドに言えることはケトン基を持つ化合物にも言えます。
(ケトン基の場合でも同様に①と②の理屈でα水素の脱離を説明できるため。)
実際、アセトンのpKaは19でありアセトアルデヒドと近い。
(アセトン:CH3COCH3)
(アセトン:CH3COCH3)
注意
上述しましたが、酸性度が高いと言っても、カルボン酸よりは全然低いです。
アセトアルデヒドのpKaは17で、酢酸のpKaは4.76です。
つまり、1012ぐらいカルボン酸の方が、ブレンステッド酸性が強い。
なので酸性を示すといっても、一般的には弱い部類です。
重要な性質(求核剤として働く)
アルデヒドのα水素が脱離して、その部分でカルボアニオンが生成しますが、これは非常に重要です。
このカルボアニオンはエノラートアニオンと言われ、酸性または塩基性溶液中で求核剤として働き、アルドール縮合などの炭素-炭素結合を生成する反応を起こします。
まとめ
アルデヒドはα水素がプロトンとして脱離しやすいという特徴があります。
なので弱いブレンステッド酸性を示します。
同様なことがカルボニル基をもつ化合物全般に言えます。
スポンサーリンク
スポンサーリンク















