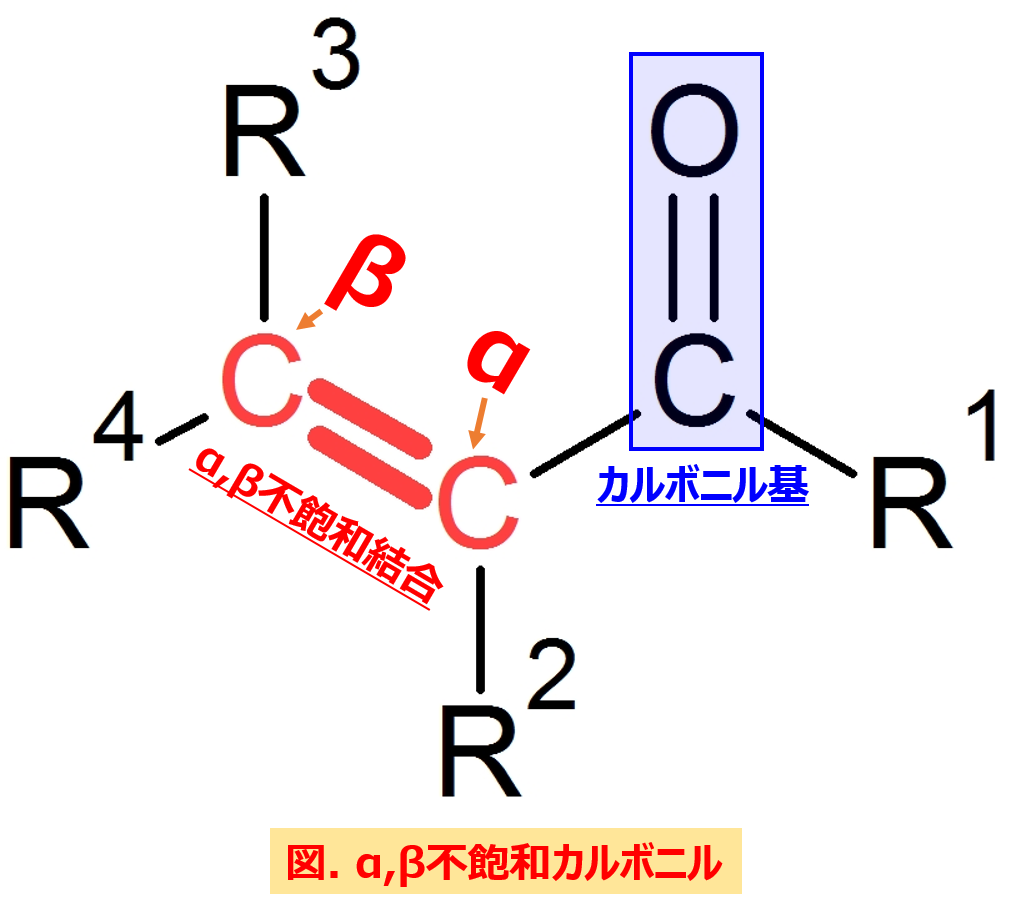
マイケル付加反応は、『α,β不飽和カルボニル』に対して起こす付加反応の一種です。
求核剤と求電子剤の反応です。
しかし、α,β不飽和カルボニルには、求核剤がアタック可能な箇所が2か所あります。
それはカルボニル炭素と二重結合のβ炭素の2つです。
(どちらも電子不足で+に電荷が偏っているため)
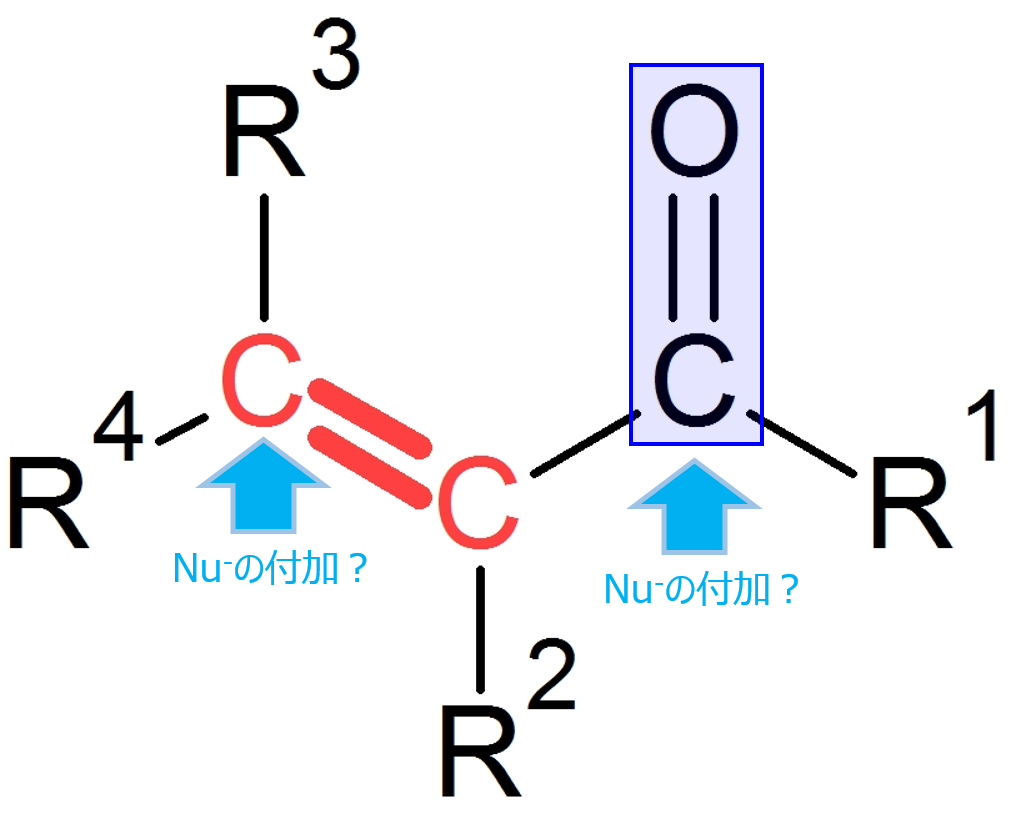
ではマイケル付加において、求核剤はカルボニル炭素or二重結合のどちらに対して攻撃するのでしょうか?
反応条件によって変わる
求核剤がカルボニル基と二重結合(のβ炭素)のどちらに付加するのかですが、それは求核剤の種類や温度などによって変わります。
というのも、どちらに結合するかは『速度論支配vs熱力学支配』によって変わるためです。
速度論支配vs熱力学支配
速度論支配と熱力学支配。有機化学を習った人なら聞いたことがあるかと思います。
速度論支配とは、簡単に言えば『活性化エネルギー』が小さいので反応速度的には速いが、『熱力学的安定性(≒反応熱)』が低いので逆反応も起こってしまい、平衡反応となるもの。
一方の熱力学支配とは、『活性化エネルギー』は大きいのでなかなか反応は起こらないが、起こってしまえば、『熱力学的安定性(≒反応熱)』が大きいので安定する。(不可逆反応)
αβ不飽和カルボニルに関していえば、カルボニル炭素への付加反応が『速度論支配』で、二重結合のβ炭素への付加反応は『熱力学支配』です。
つまり、活性化エネルギーと熱力学的安定性を図にすると以下のようになります。
| カルボニル炭素(C=O) | 二重結合のβ炭素(C=C) | |
| 活性化エネルギー | 小 | 大 |
| 熱力学的安定性 | 小 | 大 |
二重結合への付加反応の方が優先。
解説
ある条件での出来事
速度論的にはカルボニル炭素への求核による付加反応が優先して起こるが、熱力学安定性が低く可逆反応なのでくっついたり離れたりします。
その間に、高活性化エネルギーのため速度論的には遅かったβ炭素への付加反応も徐々に起こってきますが。できた生成物は熱力学的安定性が大きいので、徐々に生成割合が大きくなります。
強い求核剤を使うと?
ただし、H-(ヒドリド)などの強い求核剤の場合は、生成物の安定性が大きいのでカルボニル炭素に付加して安定します。
カルボニル炭素は活性化エネルギーが低いため優先的に反応。
↓
ヒドリドの付加生成物の熱力学的安定性も大きいので平衡は不可逆反応であり安定。
↓
二重結合への付加物は少数派となる。
まとめ
マイケル付加と言われるα,β不飽和カルボニルへの付加反応は、2箇所のアタック箇所があります。
求核剤がどちらに付加するか?については、『速度論支配』『熱力学支配』『求核剤』の3つのパラメータを考慮することで予想することが可能です。
前述のように、反応の初期ではカルボニル基への付加物が多く、時間の経過とともにβ炭素への付加物が多くなるような状況も考えられます。
とは言え、実際には実験しないことには簡単にはわからないと思います。